 お知らせ
お知らせ
造血幹細胞移植後の非感染性肺合併症に対する 臍帯由来間葉系細胞輸注療法の第Ⅱ相試験治験届提出
~へその緒からの細胞で世界初の治療法確立に挑戦~
臍帯(へその緒)の細胞で世界に先駆けた医薬品化を目指すヒューマンライフコード株式会社(代表取締役社長:原田 雅充、所在地:東京都中央区、以下「当社」)は、造血幹細胞移植後の非感染性肺合併症(※1)に対する臍帯由来間葉系細胞輸注療法の第Ⅱ相試験について、2022 年 3 月 3 日に独立行政法人医薬品医療機器総合機構(PMDA)へ治験計画届書を提出し受理されました。
【背景】
造血幹細胞移植は、通常の化学療法や免疫抑制療法だけでは治すことが難しい血液がんや免疫不全症などに対して、完治させることを目的として行う治療ですが、移植後の 30%程度が非感染性肺合併症を発症し、患者の QOL が著しく低下するのみならず、死に至る生命に重大な影響を及ぼします。
移植後非感染性肺合併症は、標準治療のステロイドに対する反応は悪く、一旦ステロイド抵抗性(適切なステロイド治療を行っても病状に改善がみられない)になると不可逆的に進行し、致死率が高いにも関わらず、未だ確立された治療法が存在しない希少・難治性疾患です。唯一の根治療法は肺移植ですが、その適応は限定的であるため、新たな治療法の開発とその実用化が医療現場から強く求められています。
【本治験について】
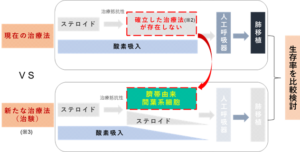
本治験は、造血幹細胞移植後のステロイド抵抗性の非感染性肺合併症である特発性肺炎症候群(IPS)を対象とし、当社が開発する臍帯由来間葉系細胞輸注療法により過活動な免疫や過剰な炎症を抑制すると共に、肺障害に対する組織修復を促し、人工呼吸管理に至らしめない呼吸機能の回復、ひいては生存率を向上させることを目的としています。
当社は、これまでに本疾患と類似するステロイド抵抗性の急性移植片対宿主病および新型コロナウイルスに伴う急性呼吸窮迫症候群を対象とした第Ⅰ相試験を実施しており、過剰炎症を伴うこれらの疾患に対して安全であり、効果が期待できるエビデンスを得ています。
日本のみならず世界においても本疾患に対する有用な治療法は確立されておりません。当社は、世界に先駆けて、臍帯由来間葉系細胞による治療法を確立するため、患者の生存率を主要評価項目とした有効性、および安全性を検討するための第Ⅱ相試験を実施いたします。
【当社代表取締役社長 原田 雅充のコメント】
ヒューマンライフコードは、一人でも多くの患者さんに新たな希望をお届けできるよう、臍帯由来間葉系細胞の特性を活かし、治療選択肢が限られているグローバル・アンメット・メディカル・ニーズ(満たされない医療ニーズ)の高い疾患に開発の重点を置いています。今回の対象疾患である造血幹細胞移植後の非感染性肺合併症は、今現在も有効な治療の手段がないため致死率が高く、かつ国内では300名ほど、世界においても3,500名ほど(※4)と患者数が極めて少ない希少・難治性疾患です。そのためいくつもの困難が予想されますが、待っている患者さんを中心とした開発担当者・治験参加医師・規制当局の心を一つにして、世界的にも前人未到の疾患に果敢に挑み、“つなぐ命のきずな つながる未来”を使命に、私たちだからこそできる社会貢献のかたちを追求していきます。
※1 造血幹細胞移植後非感染性肺合併症とは、造血幹細胞を移植後に、感染症ではない原因により肺炎などの肺障害が起こることです。主な非感染性肺合併症として特発性肺炎症候群(IPS)があります。IPSは移植後早期に発症することが多く、さまざまな原因から肺にある肺胞の壁に炎症や損傷が起こり、壁が厚くなり(線維化)、ガス交換がうまくできなくなる病気です。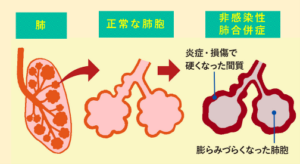
※2 現行の治療は、ステロイドに加えて免疫抑制剤を追加する治療や未承認薬が使われています。
※3 本治験では、臍帯由来間葉系細胞の投与により、基礎治療としてのステロイドおよび酸素吸入量を減少させる、もしくは
離脱させることで人工呼吸器に至らしめない治療法を目指します。結果として、生存率が向上することを期待します。
※4 第40回厚生科学審議会疾病対策部会 造血幹細胞移植委員会資料より患者数を推定。
